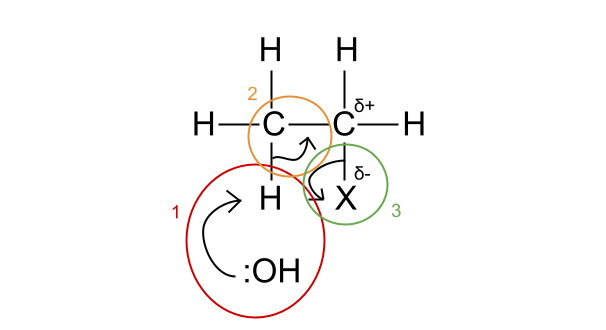Se ci pensiamo bene, ha senso. Eliminare qualcosa vuol dire sbarazzarsene. Nelle reazioni di eliminazione ci si libera alcune parti di una molecola.
 Figura 1. Esempio di reazione di eliminazione. Si noti come gli atomi indicati in rosso vengano persi dalla molecola.
Figura 1. Esempio di reazione di eliminazione. Si noti come gli atomi indicati in rosso vengano persi dalla molecola.
Reazioni di eliminazione con alogenuri alchilici
Una reazione di eliminazione può avvenire tra lo ione idrossido :OH- e un alogenuro alchilico. Questa reazione produce acqua, uno ione alogenuro e un alchene.
Ricordiamo che un alogenuro alchilico è un idrocarburo contenente uno o più atomi di alogeno. Un esempio è il clorometano, CH3Cl, mostrato di seguito.
 Figura 2. Clorometano, un esempio di alogenuro alchilico.
Figura 2. Clorometano, un esempio di alogenuro alchilico.
Lo ione idrossido agisce come base accettando un protone H+ , dall'alogenuro alchilico per formare acqua.
Una base è semplicemente un accettore di protoni.
Uno degli atomi di carbonio adiacenti perde uno ione alogenuro per ottenere una struttura stabile. Questa operazione è nota anche come deidroalogenazione. Di seguito è riportato il meccanismo generale, utilizzando X per rappresentare l'alogeno.
 Figura 3. Meccanismo generali per le reazioni che coinvolgono alogenuri alchilici.
Figura 3. Meccanismo generali per le reazioni che coinvolgono alogenuri alchilici.
La seguente rappresentazione può aiutarti a capire il meccanismo.
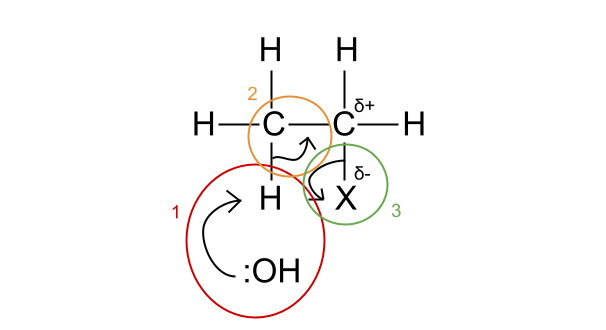
Figura 4. Meccanismo per l'eliminazione.
- Lo ione idrossido attacca un atomo di idrogeno con la sua coppia di elettroni spaiati. Si noti a quale atomo di carbonio è attaccato questo atomo di idrogeno: è sempre un atomo di carbonio adiacente al legame C-X.
- La coppia di elettroni del legame C-H diventa ora parte di un doppio legame C=C.
- L'alogeno prende la coppia di elettroni dal legame C-X e viene espulso come gruppo uscente.
Un gruppo uscente è un frammento di molecola che si allontana dalla molecola iniziale in una reazione chimica. Quando il legame chimico che unisce il gruppo uscente alla molecola madre viene spezzato, la coppia di elettroni di legame si sposta sul gruppo uscente.
Il reagente è l'idrossido di potassio KOH o l'idrossido di sodio NaOH. La reazione avviene sotto riflusso in presenza di etanolo a caldo e lo ione sodio o potassio reagisce con lo ione alogenuro per formare un alogenuro di sodio o di potassio.
Suggerimento per lo studio: ricorda che l'eliminazione avviene in presenza di etanolo e NON in condizioni acquose.
Questo tipo di eliminazione ha il cosiddetto meccanismo E2, perché ci sono due specie coinvolte nella parte lenta iniziale della reazione. È possibile anche un meccanismo E1, ma si tratta di un processo più complicato.
Alogenuri alchilici
Affinché avvenga l'eliminazione, deve esserci un idrogeno su un carbonio adiacente a quello legato all'alogeno. Sembra più complicato di quanto non sia! Il modo più semplice per capire se un alogenuro alchilico è adatto è disegnare la molecola, quindi seguire questi semplici passaggi:
- Cerchiare il legame C-X.
- Identificare i carboni adiacenti.
- Verificare se uno di questi carboni adiacenti contiene un legame C-H.
Se questo succede, il vostro alogenuro alchilico può reagire!
 Figura 5. Identificare gli alogenuri alchilici.Nota che il carbonio coinvolto nel legame C-X è legato anche ad un gruppo R. Questo potrebbe essere utile per l'eliminazione
Figura 5. Identificare gli alogenuri alchilici.Nota che il carbonio coinvolto nel legame C-X è legato anche ad un gruppo R. Questo potrebbe essere utile per l'eliminazione
Ad esempio, una reazione di eliminazione potrebbe avvenire tra uno ione idrossido e il 2-bromobutano, ma non con l'1-bromo-2,2-dimetilpropano. Di seguito abbiamo disegnato queste molecole, indicando i passaggi descritti in precedenza per rendere più chiara la spiegazione:
 Figura 6. Trovare gli alogenuri alchilici per l'eliminazione.
Figura 6. Trovare gli alogenuri alchilici per l'eliminazione.
Prodotti
A seconda dell'alogenuro alchilico utilizzato, in una reazione di eliminazione si possono formare più alcheni diversi. Questo perché potrebbero esserci più carboni con un legame C-H adiacente al carbonio legato al C-X, e quindi possono essere attaccati diversi atomi di idrogeno. Alcuni di questi alcheni possono essere stereoisomeri.
Gli stereoisomeri sono molecole che hanno la stessa formula strutturale ma una diversa disposizione spaziale degli atomi.
Ad esempio, la reazione tra 2-clorobutano e idrossido di potassio può produrre tre diversi alcheni:
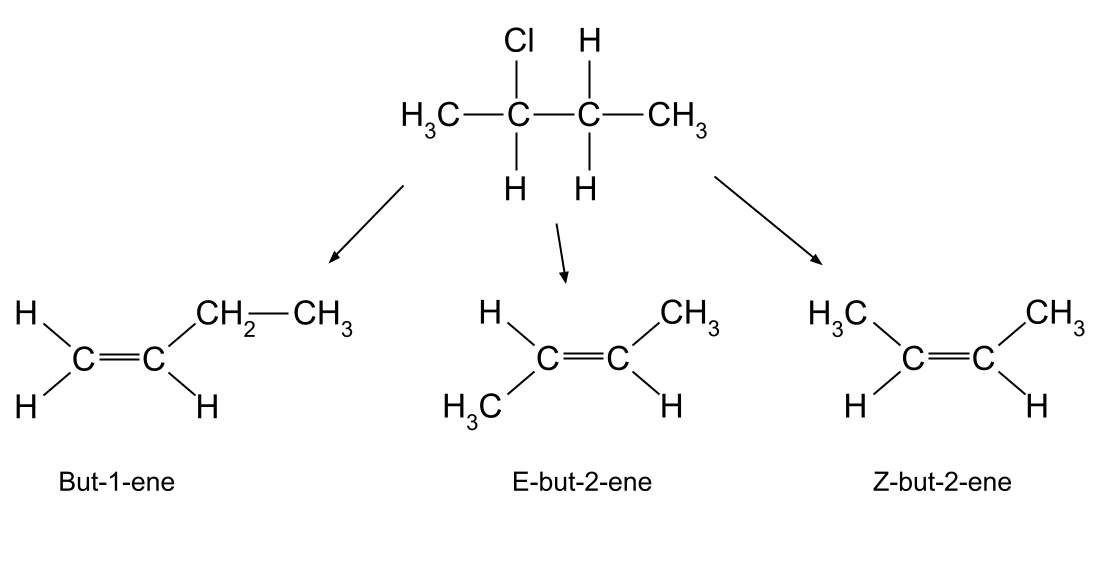
Figura 7. Eliminazione con 2-clorobutano .
Per ulteriori informazioni sugli stereoisomeri, vedere Isomerismo.
Reattività degli alogenuri alchilici
Alcuni alogenuri alchilici sono molto più reattivi di altri. Lo iodopropano, ad esempio, reagisce più velocemente con gli ioni idrossido rispetto al cloropropano. Questo perché il legame C-I ha un'entalpia di legame più bassa rispetto al legame C-Cl. Lo iodio è un atomo più grande del cloro e quindi la coppia di elettroni coinvolti nel legame C-X è più lontana dal nucleo. Ciò significa che l'attrazione tra il nucleo e gli elettroni è più debole e il legame è più facile da rompere.
Per approfondire la reattività degli alogenuri alchilici, si veda la sezione Alogenuri alchilici.
Reazioni di eliminazione vs reazioni di sostituzione
Quando si effettua una reazione di eliminazione, si verifica sempre una sostituzione e viceversa. Tuttavia, le condizioni di reazione possono essere controllate per favorire l'una o l'altra reazione. La tabella seguente riassume le analogie e le differenze tra le sostituzioni di eliminazione e nucleofile degli alogenuri alchilici. Le condizioni favorite, l'alogenuro alchilico favorito e il ruolo dello ione idrossido saranno analizzati più avanti.
Nome | Sostituzione nucleofila | Eliminazione |
Reagenti | Alogenuro alchilico + KOH o NaOH diluito | Alogenuro alchilico + KOH o NaOH concentrato |
Condizioni favorite | Caldo, acquoso | Etanolo, bollente |
Alogenuro alchilico favorito | Primario | Terziario |
Prodotti | Alcol + KX o NaX | Alchene + H2O |
Ruolo ione idrossido | Nucleofilo | Base |
Comparazione tra la sostituzione nucleofila e la reazione di eliminazione
Condizioni favorite
Abbiamo detto sopra che l'eliminazione richiede idrossido di potassio etanolico. In realtà, il solvente utilizzato è circa un 50:50 di etanolo e acqua. Si ricorda che gli alogenuri alchilici sono insolubili in acqua (vedi Reazioni di sostituzione nucleofila), quindi è necessaria una piccola quantità di etanolo per scioglierli. Questo vale sia per le reazioni di eliminazione che per le reazioni di sostituzione nucleofila. Tuttavia, la temperatura esatta e la proporzione tra etanolo e acqua nel solvente influenzano la reazione dominante:
- Le condizioni calde favoriscono la sostituzione nucleofila, mentre quelle bollenti l'eliminazione.
- Una soluzione più acquosa, cioè diluita, favorisce la sostituzione nucleofila, mentre una soluzione più etanolica favorisce l'eliminazione.
- L'utilizzo di idrossido di sodio o di potassio più concentrato favorisce l'eliminazione.
Suggerimento per lo studio: impara a conoscere le condizioni di reazione richieste dalla vostra commissione d'esame. Alcune commissioni d'esame si accontentano di una soluzione acquosa per le reazioni di sostituzione nucleofila e di una soluzione etanolica per l'eliminazione, mentre altre vogliono che si approfondiscano le condizioni, come indicato sopra.
Alogenuri alchilici favoriti
Il tipo di alogenuri alchilico utilizzato come reagente influisce sulla reazione dominante. Gli alogenuri alchilici terziari contengono tre gruppi alchilici attaccati al carbonio con il legame C-X, mentre gli alogenuri alchilici primari ne hanno al massimo uno. Ciò significa che gli alogenuri alchilici terziari hanno più opportunità di eliminazione, semplicemente perché hanno più carboni con idrogeni adiacenti al carbonio legato al C-X. Pertanto, l'uso di alogenoderivati terziari favorisce l'eliminazione, mentre l'uso di alogenoderivati primari favorisce la sostituzione nucleofila.
 Figura 8. Il tipo di alogenuro alchilico utilizzato ha un effetto su quale reazione è favorita.
Figura 8. Il tipo di alogenuro alchilico utilizzato ha un effetto su quale reazione è favorita.
Il ruolo dello ione idrossido
Lo ione idrossido assume ruoli diversi nell'eliminazione e nella sostituzione nucleofila, anche se ciò non influisce sul tipo di reazione dominante. Nell'eliminazione, lo ione idrossido agisce come base, mentre nella sostituzione nucleofila agisce come nucleofilo.
- Una base è un accettore di protoni. Nell'eliminazione, lo ione idrossido prende un protone da uno dei carboni adiacenti al carbonio con il legame C-X.
- Un nucleofilo è un donatore di coppie di elettroni. Nella sostituzione nucleofila, lo ione idrossido dona la sua coppia solitaria di elettroni all'atomo di carbonio parzialmente carico, causando la sostituzione dell'alogeno dalla molecola.
Esempi di reazioni di eliminazione con alogenuri alchilici
Il 2-cloropropano subisce l'eliminazione in idrossido di sodio etanolico caldo, come mostrato di seguito. Sebbene gli idrogeni su entrambi i carboni 1 e 3 possano essere attaccati, gli alcheni prodotti sono identici, quindi non si producono isomeri. In entrambi i casi, i prodotti sono propene, acqua e lo ione cloruro, che reagisce con il sodio per formare cloruro di sodio:
 Figura 9. Eliminazione del 2-cloropropano per formare il propene, l'acqua e lo ione cloruro.
Figura 9. Eliminazione del 2-cloropropano per formare il propene, l'acqua e lo ione cloruro.
Un altro esempio di reazione di eliminazione con un alogenuro alchilico è l'eliminazione del 2-bromo-2-metilbutano utilizzando idrossido di potassio. Si ottengono così due alcheni diversi:
 Figura 9. Eliminazione del 2-bromo-2-metilbutano
Figura 9. Eliminazione del 2-bromo-2-metilbutano
Altre comuni reazioni di eliminazione
Un altro tipo di reazione di eliminazione è la disidratazione degli alcoli per formare alcheni. (Vedere Reazioni di eliminazione degli Alcoli).
Reazioni di eliminazione - Punti chiave
- Le reazioni di eliminazione sono reazioni in cui due atomi, o gruppi di atomi, vengono rimossi da una molecola per formare un nuovo prodotto.
- Le reazioni di eliminazione con ioni idrossido e alogenuri alchilici avvengono in condizioni calde ed etanoliche e producono acqua, uno ione alogenuro e un alchene. Questa reazione è nota anche come deidroalogenazione e ha un meccanismo E2.
- Nelle reazioni di eliminazione, lo ione idrossido agisce come base, mentre nella sostituzione nucleofila agisce come nucleofilo.
- Le condizioni di reazione possono essere modificate per favorire l'eliminazione o la sostituzione nucleofila.